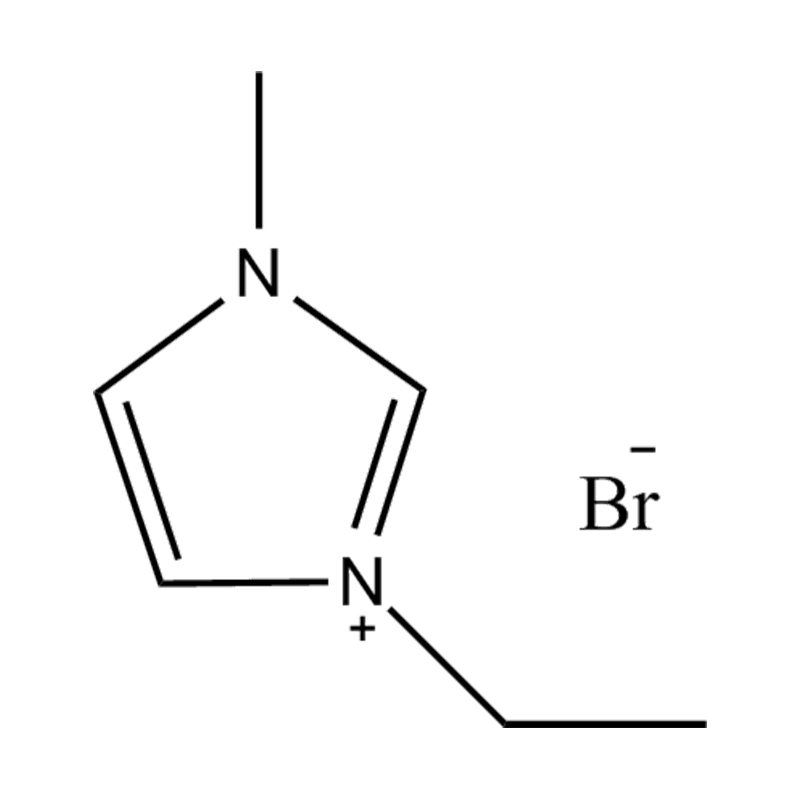
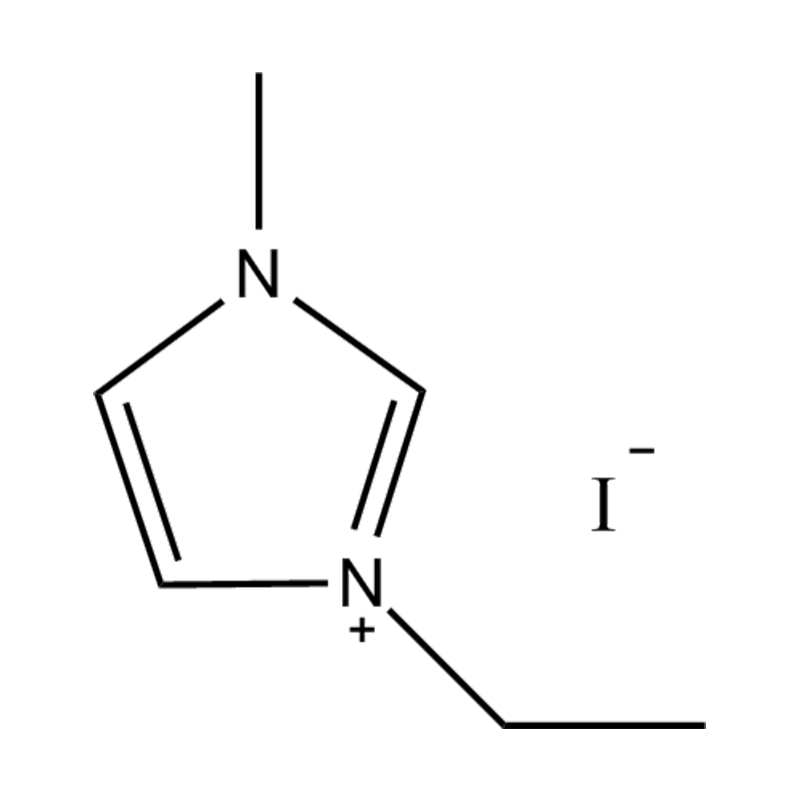
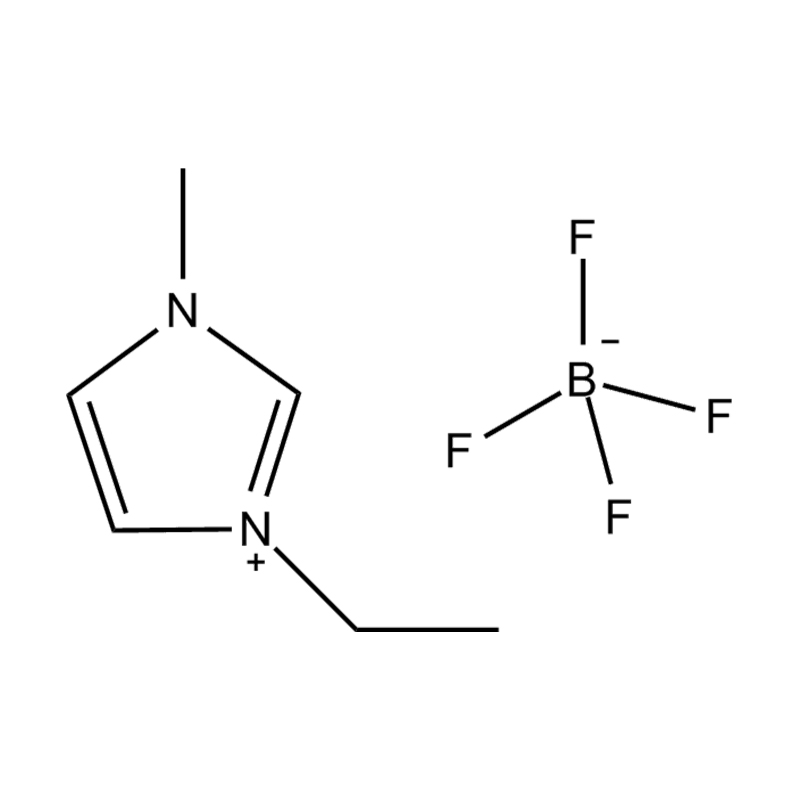
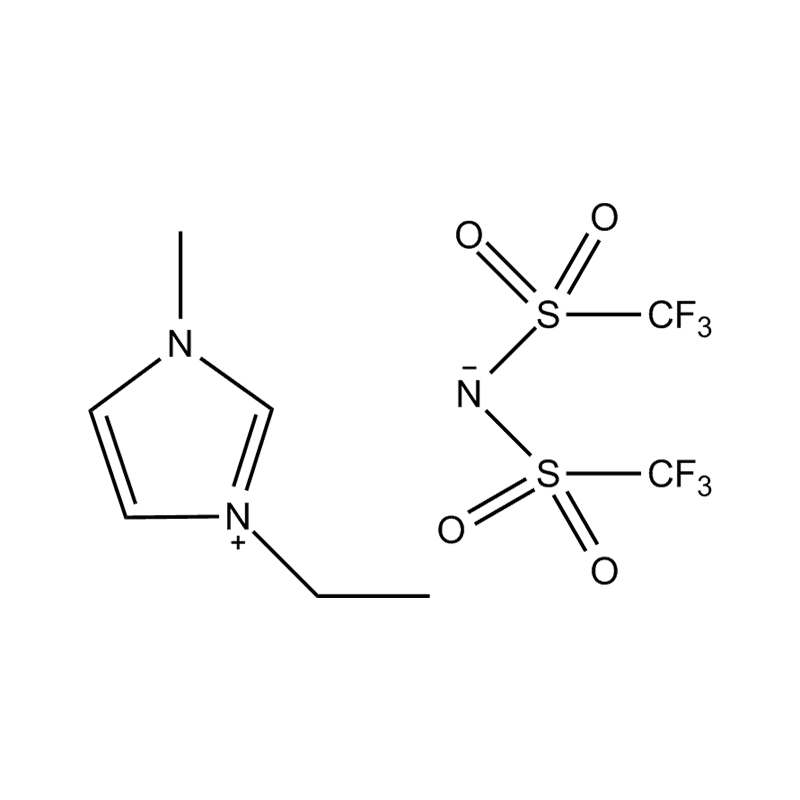
Cecair ionik imidazole yang dipisahkan (ILS) adalah kelas cecair ionik khusus di mana cincin imidazole digantikan pada dua kedudukan dengan kumpulan berfungsi. Pengubahsuaian ini mempengaruhi mereka dengan ketara sifat fizikokimia , menjadikan mereka sangat serba boleh untuk aplikasi dalam pemangkinan, elektrokimia, kimia hijau, dan sains bahan. Memahami sifat -sifat ini adalah penting untuk penyelidik dan jurutera yang ingin memanfaatkan prestasi cecair ionik ini dalam pelbagai proses kimia dan perindustrian.
1. Kelikatan
Kelikatan adalah parameter utama yang mempengaruhi tingkah laku aliran, pemindahan jisim, dan kecekapan proses cecair ionik. ILS imidazole yang tidak disubstitusi biasanya dipamerkan:
- Kelikatan sederhana hingga tinggi Berbanding dengan cecair ionik imidazolium monosubstituted atau mudah disebabkan peningkatan interaksi molekul daripada substituen tambahan.
- Kelikatan Tunable : Dengan berhati -hati memilih jenis dan saiz substituen, kelikatan boleh diselaraskan untuk aplikasi tertentu, seperti pemangkinan atau sistem pelarut.
- Pergantungan suhu : Kelikatan berkurangan dengan peningkatan suhu, memudahkan pengendalian yang lebih mudah dan pemindahan jisim yang lebih baik pada suhu tinggi.
Kelikatan yang boleh ditukar ini membolehkan ILS imidazole yang tidak disubstitusi digunakan sebagai pelarut, elektrolit, atau media tindak balas di mana aliran terkawal dan kadar penyebaran adalah kritikal.
2. Kestabilan haba
Kestabilan haba adalah harta yang menentukan yang menentukan julat suhu operasi cecair ionik:
- Kestabilan terma yang dipertingkatkan : ILS imidazole yang disubstitusi umumnya menahan suhu sehingga 300-400 ° C tanpa penguraian yang ketara, bergantung kepada substituen dan jenis anion.
- Rintangan terhadap degradasi : Substituen tambahan boleh memberikan penghalang sterik dan menstabilkan cincin imidazole, mengurangkan kemungkinan kerosakan haba.
- Kelebihan Permohonan : Kestabilan terma yang tinggi menjadikan IL ini sesuai untuk tindak balas suhu tinggi, peranti elektrokimia, dan proses perindustrian di mana pelarut organik konvensional akan menguap atau mengurai.
3. Kekonduksian Ionik
Kekonduksian ionik adalah penting untuk aplikasi di elektrokimia, bateri, dan supercapacitors :
- Kekonduksian ionik yang sederhana hingga tinggi : ILS imidazole yang tidak disubstitusi membolehkan mobiliti ion yang berkesan, dengan nilai kekonduksian yang dipengaruhi oleh saiz, simetri, dan polariti substituen.
- Interaksi kation-anion : Substituen mengubah interaksi elektrostatik, memberi kesan kepada pemisahan ion dan, akibatnya, kekonduksian keseluruhan.
- Kesan suhu dan kelikatan : Kekonduksian bertambah pada suhu yang lebih tinggi disebabkan oleh kelikatan yang menurun dan mobiliti ion yang dipertingkatkan.
Ciri -ciri ini membolehkan ILS imidazole yang tidak disubstitusi berfungsi sebagai elektrolit dalam peranti penyimpanan tenaga, elektroplating, dan sintesis elektrokimia.
4. Kelarutan dan polariti
Kehadiran dua substituen pada cincin imidazole mengubah kelarutan dan ciri -ciri kutub:
- Kelarutan yang dipertingkatkan : Bergantung pada kumpulan berfungsi, IL ini boleh membubarkan pelbagai bahan organik, bukan organik, dan polimer.
- Polariti laras : Substituen boleh meningkatkan atau mengurangkan polariti keseluruhan cecair ionik, menyesuaikannya untuk pelarut tertentu atau media tindak balas.
- Keserasian dengan pemangkin : Profil kelarutan membolehkan ILS imidazole yang tidak disubstitusi untuk menyokong pemangkinan homogen dan menstabilkan kompleks logam.
5. Sifat -sifat fizikokimia Pelbagai
Ciri -ciri tambahan yang dipengaruhi oleh pemisahan termasuk:
- Hidrofobisiti atau hidrofilik : Substituen boleh mengalihkan cecair ionik dari larut air ke air-tidak dapat dilepaskan, membolehkan sistem pelarut terpilih.
- Ketumpatan dan ketegangan permukaan : Pengubahsuaian kepada cincin imidazole mempengaruhi pembungkusan dan interaksi intermolecular, mempengaruhi ketumpatan dan tingkah laku interfacial.
- Tingkap elektrokimia : IL yang tidak disubstitusi sering dipamerkan tingkap elektrokimia yang lebih luas , membolehkan penggunaannya dalam aplikasi elektrokimia voltan tinggi.
6. Implikasi praktikal
Ciri -ciri fizikokimia yang unik dari cecair ionik imidazole yang tidak disubstitusi menjadikannya sesuai untuk pelbagai aplikasi:
- Pelarut hijau : Kestabilan terma mereka, turun naik yang rendah, dan polaritas yang boleh ditukar membolehkan mereka menggantikan pelarut organik yang tidak menentu dalam proses mesra alam.
- Elektrolit : Kekonduksian ionik yang tinggi dan tingkap elektrokimia yang luas menjadikannya sesuai untuk bateri, sel bahan api, dan supercapacitors.
- Pemangkinan : Kelarutan dan kelikatan yang boleh dioptimumkan mengoptimumkan keadaan tindak balas dan meningkatkan kecekapan pemangkin.
- Sintesis Bahan : Penstabilan nanopartikel dan polimer dalam cecair ionik difasilitasi oleh interaksi kation-anion yang disesuaikan.
Kesimpulan
Cecair ionik imidazole yang tidak disubstitusi mempamerkan gabungan Kelikatan Tunable, Kestabilan Thermal yang Tinggi, Kekonduksian Ionik yang Cemerlang, dan Kelarutan Laras , menjadikan mereka alat serba boleh dalam kimia dan kejuruteraan moden. Dengan memilih substituen dan penentangan yang sesuai, penyelidik dapat merancang cecair ionik yang memenuhi syarat khusus untuk Kimia Hijau, Elektrokimia, Pemangkinan, dan Sains Bahan . Ciri-ciri fizikokimia mereka yang unik bukan sahaja meningkatkan kecekapan proses tetapi juga menyumbang kepada pembangunan sistem kimia yang lebih mampan dan berprestasi tinggi.



 中文简体
中文简体